
Cinko jonai (Zn2+) slopina koronavirusų ir arterivirusų RNR polimerazės aktyvumą in vitro, o cinko jonoforai blokuoja šių virusų dauginimąsi ląstelių kultūrose
Aartjan J. W. te Velthuis1, Sjoerd H. E. van den Worm1, Amy C. Sims2, Ralph S. Baric2, Eric J. Snijder1*, Martijn J. van Hemert1*1 Molekulinės virusologijos laboratorija, Medicinos mikrobiologijos skyrius, Infekcinių ligų centras, Leideno universiteto medicinos centras, Leidenas, Nyderlandai.
2 Epidemiologijos, mikrobiologijos ir imunologijos skyriai, Šiaurės Karolinos Čapel Hilio universitetas, Čapel Hilis, Šiaurės Karolina, Jungtinės Amerikos Valstijos.
Santrauka
Viduląstelinio Zn2+ jonų koncentracijos padidinimas cinko jonoforais, pvz. piritionu (PT, angl. pyrithione) gali veiksmingai sutrikdyti įvairių RNR virusų, įskaitant poliomielito ir gripo virusus, dauginimąsi. Kai kurių virusų atveju šis poveikis buvo susietas su viruso polibaltymo apdorojimo blokavimu. Šio tyrimo rezultatai rodo, jog Zn2+ ir PT derinys, esant mažoms jų koncentracijoms (2 µm Zn2+ ir 2 µm PT), slopina SŪRS koronaviruso (angl. SARS-CoV) ir arklių arterito viruso (EAV, angl. equine arteritis virus) dauginimąsi ląstelių kultūrose. Šių dviejų tolimai susijusių nidovirusų RNR sintezę katalizuoja nuo RNR priklausoma RNR polimerazė (RdRp; angl. RNR-dependent RNA polymerase), kuri yra pagrindinis daugiabaltyminio replikacijos ir transkripcijos komplekso (RTC, angl. replication and transcription complex) fermentas. RTC, išskirtų iš SARS-CoV ir EAV užkrėstų ląstelių, tokiu būdu pašalinus poreikį PT pernešti Zn2+ per plazminę membraną, aktyvumo tyrimais nustatėme, jog Zn2+ jonai veiksmingai slopina abiejų virusų RTC RNR sintezės aktyvumą. Rekombinantinių RdRp (SARS-CoV nsp12 ir EAV nsp9) baltymų, išgrynintų iš E. coli, fermentiniai tyrimai atskleidė, kad Zn2+ jonai tiesiogiai blokuoja abiejų nidovirusų polimerazių aktyvumą in vitro. Konkrečiau, Zn2+ jonai blokuoja EAV RNR sintezės iniciacijos etapą, o SARS-CoV atveju slopina RdRp vykdomą elongaciją ir mažina matricos prisijungimą. Zn2+ chelavimas su MgEDTA gali panaikinti šio divalenčio katijono slopinantį poveikį. Šis procesas suteikia naują eksperimentinį įrankį nidovirusų replikacijos ir transkripcijos molekuliniams elementams in vitro tirti.
Citavimas: te Velthuis AJW, van den Worm SHE, Sims AC, Baric RS, Snijder EJ, et al. (2010) Zn2+ Inhibits Coronavirus and Arterivirus RNA Polymerase Activity In Vitro and Zinc Ionophores Block the Replication of These Viruses in Cell Culture. PLoS Pathog 6(11): e1001176. doi:10.1371/journal.ppat.1001176
Redaktorius: Raul Andino, Kalifornijos San Francisko universitetas, Jungtinės Amerikos Valstijos.
Gauta: 2010 m. gegužės 17 d. Priimta: 2010 m. spalio 1 d. Išspausdinta: 2010 m. lapkričio 4 d.
Autorinės teisės: © te Velthuis ir kt. Tai yra atviros prieigos straipsnis, platinamas pagal „Creative Commons Attribution“ licenciją, kuri leidžia neribotai naudoti, platinti ir dauginti šį straipsnį su sąlyga, kad yra nurodomas originalus šaltinis ir autoriai.
Finansavimas: šį darbą parėmė Nyderlandų mokslinių tyrimų organizacija (NWO), skirdama chemijos mokslų tarybos (NWO-CW) dotacijas (700.55.002 ir 700.57.301) bei NWO „Toptalent“ dotaciją (021.001.037). Tyrimą finansavę asmenys neturėjo įtakos pasirenkant tyrimo modelį, renkant ir analizuojant duomenis ar priimant sprendimus dėl rankraščio publikavimo ar rengimo.
Interesų priešprieša: autoriai patvirtino, kad neturi konkuruojančių interesų.
El. paštas: e.j.snijder@lumc.nl (ES); m.j.van_hemert@lumc.nl (MJvH)
Įžanga
Cinko jonai dalyvauja daugybėje skirtingų ląstelės procesų ir turi esminės įtakos įvairių fermentų ir transkripcijos faktorių aktyvumui bei teisingam susilankstymui. Zn2+ jonai greičiausiai yra svarbus daugybės virusinių baltymų kofaktorius. Nepaisant to, viduląstelinė laisvo Zn2+ koncentracija metalotioneinų yra palaikoma sąlyginai žema, greičiausiai dėl to, kad Zn2+ gali veikti kaip antrinis viduląstelinis signalo pernešėjas ir, esant padidėjusiai jo koncentracijai, suaktyvinti apoptozę ar sumažinti baltymų sintezę [1,2,3]. Tiriant ląstelių kultūras pastebėta, jog didelės Zn2+ koncentracijos ir Zn2+ pernašą į ląstelę stimuliuojančių junginių, tokių kaip hinokitolis (HK), pirolidino ditiokarbamatas (PDTC) ir pirotionas (PT), pridėjimas slopina įvairių RNR virusų, įskaitant gripo [4], kvėpavimo takų sincitinio viruso [5] ir keleto pikornavirusų [6,7,8,9,10,11], dauginimąsi. Nors šie ankstesni tyrimai suteikė mažai fizinius procesus apibūdinančios informacijos, jie leidžia manyti, kad viduląstelinio Zn2+ lygis paveikia bendrą šiems virusams dauginimosi ciklo etapą.
Ląstelių kultūroje PT per kelias minutes stimuliuoja Zn2+ įsisavinimą ir slopina RNR virusų dauginimąsi mechanizmu, kurio detalesni tyrimai atlikti tik su pikornavirusais [11,12]. Rinovirusų ir poliomielito virusų 3C proteazių in vitro tyrimai atskleidė, kad Zn2+ jonai slopina proteazių aktyvumą [13,14]. Šie duomenys atitinka žmogaus rinovirusu ir koksaki virusu B3 užkrėstose ląstelėse stebėtą cinko jonų sukeltą polibaltymų apdorojimo slopinimą [11]. Tačiau segmentuotų neigiamos grandinės RNR virusų, tokių kaip gripo virusas, dauginimasis nepriklauso nuo polibaltymų apdorojimo, o PDTC palengvintos Zn2+ pernašos efektas, spėjama, gali kilti dėl virusinės nuo RNR priklausomos RNR polimerazės (RdRp) ir ląstelinių kofaktorių slopinimo [4]. Be to, buvo stebimas iš rinovirusų ir hepatito C virusų išskirtų RdRp aktyvumą slopinantis Zn2+ poveikis, tačiau jis nebuvo detaliau tyrinėtas [15,16].
Šiuo metu nėra gerai žinoma, kaip cinko jonai veikia nidovirusus. Šiai didelei teigiamos grandinės RNR (+RNR) virusų grupei priklauso svarbiausi žmogaus ir gyvulių patogenai, tokie kaip stipraus ūminio respiracinio sindromo koronavirusas (SŪRS koronavirusas, angl. SARS-CoV), kiti žmogaus koronavirusai, arterivirusai arklių arterito virusas (EAV) ir kiaulių reprodukcinio ir respiracinio sindromo virusas (KRRSV, angl. PRRSV; porcine reproductive and respiratory syndrome virus) [17,18]. Bendrą nidovirusų kilmę atspindi panaši jų genomo sandara ir raiškos strategija bei keleto svarbių fermentinių funkcijų išsaugojimas jų dideliuose replikazės polibaltymuose [19]. Skiriamasis koronavirusų ir arterivirusų dauginimosi požymis yra 5’ bendro galo ir 3’ bendro galo subgenominių (sg) iRNR lizdinio rinkinio, nuo kurio vyksta virusinių struktūrinių ir papildomus baltymus koduojančių genų raiška, transkripcija [20,21].
Kaip ir pikornavirusų atveju [13,22], buvo parodyta, kad cinko jonai slopina kai kuriuos koronavirusų replikazės polibaltymų apdorojimo metu vykstančius proteolitinius skėlimus infekuotose ląstelėse ir beląstelinėse sistemose [23,24]. Atliekant šį tyrimą gauti duomenys rodo, kad cinko jonoforas piritionas (PT), naudojamas kartu su Zn2+, yra stiprus SŪRS koronaviruso (SŪRS-CoV, angl. SARS-CoV) ir arklių arterito viruso (EAV) slopiklis ląstelių kultūrose. Norint įvertinti, ar, nepaisant galimo proteolitinį apdorojimą slopinančio poveikio, Zn2+ tiesiogiai veikia nidovirusų RTC subvienetus ir RNR sintezę, panaudojome SARS-CoV ir EAV RNR sintezės in vitro sistemas, paremtas su membranomis susijusių RTC išskyrimu iš užkrėstų ląstelių (šios sistemos toliau vadinamomis RTC testais) [25,26]. Be to, naudojome rekombinantinių RdRp tyrimus in vitro tiesiogiai tirti cinko jonų poveikį SARS-CoV ir EAV RdRp [27,28].
Naudodami šiuos nepriklausomus in vitro metodus nustatėme, kad Zn2+ tiesiogiai silpnina nidovirusų RNR sintezę, kadangi ir RTC, ir RdRp tyrimuose jis pasižymėjo stipriu slopinančiu poveikiu. Įdomu tai, kad Zn2+ sukeltas slopinimas galėjo būti panaikinamas pridėjus Zn2+ chelatoriaus (MgEDTA). Dėl šios priežasties mes panaudojome šį junginį sustabdyti ir iš naujo pradėti RNR sintezės aktyvumą pagal poreikį. Šis patogus įrankis leido detaliau tirti įvairius mechanistinius arterivirusų ir koronavirusų RNR sintezės aktyvumo aspektus. Be to, čia aprašomas Zn2+ sukeltas nidovirusų RNR sintezės slopinimas gali tapti pagrindu toliau tyrinėti cinko jonoforų panaudojimą antivirusinėje terapijoje.
Autorių santrauka
Tarp teigiamos grandinės RNR (+RNR) virusų yra nemažai svarbių patogenų. Jie išvystė įvairiausių dauginimosi strategijų, tačiau juos sieja faktas, kad nuo RNR priklausoma RNR polimerazė (RdRp) yra pagrindinis jų RNR sintezės mechanizmo fermentas. RdRp dažnai būna įterpta į su membrana susijusį replikacijos kompleksą, kuris yra sukonstruojamas iš virusinės RNR bei viruso ir šeimininko baltymų. Kadangi RdRp atlieka gyvybiškai svarbią viruso replikacijos ciklo funkciją, jos yra pagrindiniai antivirusinių tyrimų taikiniai. Yra žinoma, kad padidėjusi viduląstelinio Zn2+ koncentracija veiksmingai sutrikdo keleto RNR virusų dauginimąsi, užblokuojant teisingą proteolitinį virusinių polibaltymų apdorojimą. Atlikdami šį tyrimą ne tik parodėme, kad koronavirusų ir arterivirusų dauginimasis gali būti blokuojamas padidinus Zn2+ lygį, tačiau taip pat panaudojome izoliuotus replikacijos kompleksus ir išgrynintas rekombinantines RdRp, norėdami įrodyti, kad šis poveikis gali būti siejamas su tiesioginiu nidovirusų RdRp slopinimu. Čia aprašytų metodų kombinacija bus naudinga atliekant nidovirusų fermentų kompleksų funkcijų tyrimus ateityje.
Rezultatai
Cinkas ir piritionas slopina nidovirusų dauginimąsi in vitro
Cinko jonai dalyvauja daugelyje ląstelės procesų, tačiau metalotioneinai palaiko sąlyginai žemą laisvo Zn2+ koncentracijos lygį [1]. Buvo nustatyta, kad Zn2+ jonai ir Zn2+ patekimą į ląsteles skatinantys junginiai, tokie kaip PT, slopina keleto pikornavirusų, įskaitant rinovirusus, snukio ir kanopų ligos virusą, koksakivirusą ir mengovirusą, dauginimąsi ląstelių kultūroje [6,7,8,9,10,11]. Norėdami nustatyti, ar Zn2+ panašiai veikia nidovirusus, ištyrėme PT ir Zn2+ poveikį EAV ir SARS-CoV replikacijai Vero-E6 ląstelėse, naudodami reporterinius virusus, sintetinančius žaliai fluorescuojančius baltymus (GFP, angl. green fluorescent proteins), pvz. EAV-GFP [29] ir SARS-CoV-GFP [30]. EAV-GFP koduoja GFP baltymą, sulietą su viruso nestruktūrinio baltymo 2 (nsp2) N-galu. Pastarasis baltymas yra vienas iš replikazės polibaltymo skėlimo produktų, todėl tiesiogiai parodo replikazės geno transliaciją. SARS-CoV-GFP atveju reporterinis baltymas sintetinamas nuo sg iRNR 7, vietoje dviejų antrinius baltymus koduojančių genų (ASR 7a ir 7b), kurie nėra reikalingi replikacijai ląstelių kultūroje.
Pirmiausiai įvertinome įvairių PT koncentracijų citotoksiškumą, esant nuo 0 iki 8 µM ZnOAc2. Neužkrėstas virusais kontrolines ląsteles paveikus PT koncentracijomis iki 32 µM kartu su < 4 µM ZnOAc2, jų gyvybingumas po 18 val. nesumažėjo (1A pav.). Gyvybingumas buvo matuojamas kolorimetriniu MTS (3-(4,5-dimetiltiazol-2-il)-5-(3-karboksimetoksifenil)-2-(4-sulfofenil)-2H-tetrazolis) gyvybingumo testu. Kadangi žinoma, jog padidėjusi Zn2+ koncentracija slopina transliaciją ląstelėje, taip pat panaudojome metabolinį žymėjimą 35S-metioninu, norėdami įvertinti PT ir Zn2+ įtaką ląstelės baltymų sintezei. 18 val. trukusi Vero-E6 ląstelių inkubacija su pirmiau minėtomis PT ir Zn2+ koncentracijomis, po kurios sekė 2 val. trukmės metabolinis žymėjimas atskleidė, jog ZnOAc2 koncentracijai esant < 4 µM ZnOAc2. bendras ląstelių baltymų sintezės lygis nesikeitė (duomenys nepateikti).
Naudojant šias ne citotoksiškas sąlygas vėliau tyrėme PT ir ZnOAc2 poveikį EAV-GFP ir SARS-CoV-GFP replikacijai. Atliekant šį tyrimą, 96 šulinėlių plokštelėse esančios Vero-E6 ląstelės buvo užkrėstos, infekcijos daugybiškumo (m.o.i., angl. multiplicity of infection) reikšmei esant 4. Praėjus vienai valandai po infekcijos (h p.i., angl. hour post infection) į kultūros terpę buvo pridėta nuo 0 iki 32 µM PT ir 0 µM, 1 µM arba 2 µM ZnOAc2. Praėjus 17 val. po infekcijos, kai abiem virusais užkrėstose nepaveiktose ląstelėse GFP raiška pasiekia didžiausią reikšmę, ląstelės buvo užfiksuotos, o GFP fluorescencija įvertinta kiekybiškai.
SARS-CoV-GFP ir EAV-GFP baltymus koduojančių reporterinių genų raiška pridėjus tik PT buvo reikšmingai slopinama, priklausomai nuo pridėtos medžiagos dozės (1B ir 1C pav.). Šis poveikis reikšmingai sustiprėjo, į terpę pridėjus 2 µM Zn2+. Nustatėme, kad pridėjus tik ZnOAc2 viruso replikacija sumažėjo, tačiau tik esant tokiam medžiagos lygiui, kuris artimas ZnOAc2 50 proc. citotoksiškumo koncentracijai (CC50, angl. cytotoxicity concentration) Vero-E6 ląstelėse (~70 µM, duomenys nepateikti). Greičiausiai taip yra dėl prasto Zn2+ tirpumo fosfatų turinčioje terpėje ir neveiksmingo Zn2+ pasisavinimo į ląsteles, kai nėra cinko jonoforų. GPF signalas sumažėjo 98 ± 1 proc. ir 85 ± 3 proc. EAV-GFP ir SARS-CoV-GFP atvejais (atitinkamai), esant 2 µM PT ir 2 µM ZnOAc2 deriniui. Esant tokiam PT ir ZnOAc2 koncentracijų deriniui, citotoksiškumas nebuvo stebimas. Iš dozės-atsako kreivių, pavaizduotų 1-ajame pav., buvo apskaičiuota 82 µM CC50 PT vertė, kartu esant 2 µM cinko. Buvo nustatytos SARS-CoV ir EAV virusų pusės maksimalios slopinančios koncentracijos (IC50, angl. inhibitory concentration) vertės, atitinkamai 1,4 µM ir 0,5 µM, bei selektyvumo indeksai, atitinkamai 59 ir 164.
Zn2+ grįžtamai slopina išskirtų nidovirusų RTC RNR sintezės aktyvumą
Anksčiau esame sukūrę testus tirti iš SARS-CoV ir EAV užkrėstų ląstelių išskirtų RTC RNR sintezės aktyvumą in vitro [25,26]. Šiuose RTC testuose [α-32P]CMP yra įterpiamas tiek į genominę (replikacija), tiek į sg iRNR (transkripcija) (2 pav.). Tai leido stebėti tų pačių virusinių RNR molekulių, kurias galima aptikti hibridizuojant RNR iš nidovirusais užkrėstų ląstelių, sintezę. Šių testų privalumas – aktyvumas nepriklauso nuo nepertraukiamos baltymų sintezės, tad galima tirti virusinės RNR sintezę nepriklausomai nuo kitų viruso replikacijos ciklo aspektų [26]. Norint ištirti, ar nidovirusų replikaciją slopinantis PT ir cinko jonų poveikis ląstelių kultūroje yra tiesioginio Zn2+ poveikio virusinės RNR sintezei atspindys, ištyrėme Zn2+ pridėjimo poveikį RTC aktyvumui. Tiek EAV (2A pav.), tiek SŪRS-CoV (2B pav.) atveju esant ZnOAc2 buvo stebimas nuo dozės priklausomas susintetintos RNR kiekio sumažėjimas. Abiejų virusų atveju buvo stebimas didesnis nei 50 proc. bendras RNR sintezės sumažėjimas, esant 50 µM Zn2+ koncentracijai, o esant 500 µM Zn2+ koncentracijai išliko mažiau nei 5 proc. aktyvumo. Abiejų genomų sintezė ir sg iRNR gamyba buvo paveikta vienodai.
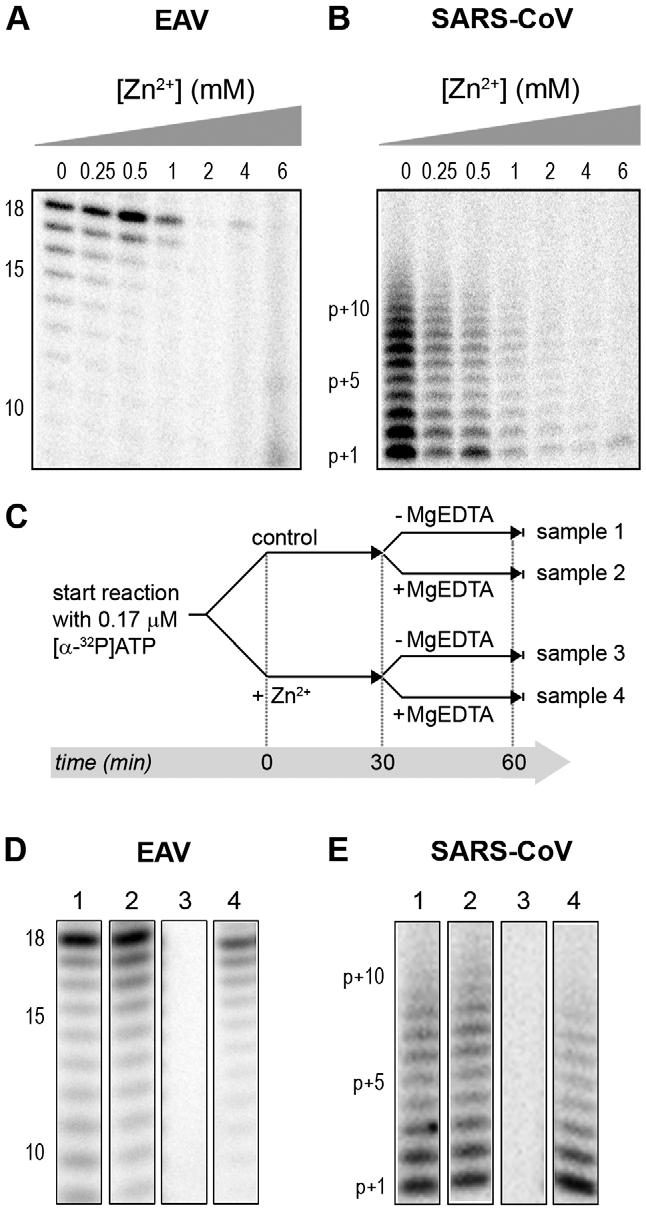
Siekiant patikrinti, ar RTC aktyvumo slopinimas Zn2+ jonais yra grįžtamas, RTC reakcijos buvo pradedamos esant arba nesant 500 µM Zn2+. Po 30 min. šios reakcijos buvo padalytos į dvi dalis ir į vieną iš mėgintuvėlių įdėta magniu praturtintos EDTA (MgEDTA) iki galutinės 1 mM koncentracijos (3A pav.). Atlikdami šiuos in vitro testus, kaip Zn2+ chelatorių naudojome MgEDTA, nes dėl didesnės ZnEDTA komplekso stabilumo konstantos ji specifiškai suriša Zn2+ ir tuo pačiu išlaisvina Mg2+. Nesujungta EDTA slopino RTC aktyvumą visose reakcijose (duomenys nepateikti), greičiausiai dėl to, kad surišo Mg2+ jonus, kurie yra būtini RdRp aktyvumui [27,28], o MgEDTA neturėjo jokio poveikio kontrolinėms reakcijoms, nesant Zn2+ (3B pav., palyginti 1-ąjį ir 2-ąjį takelius). Kaip parodyta 2-ajame pav., EAV RTC aktyvumas, kurį slopino Zn2+ (3B ir C pav., 3 takelis), galėjo būti atkurtas, pridėjus MgEDTA (3B pav., 4 takelis) iki lygio, stebimo kontrolinėse reakcijose, nesant Zn2+ (3B pav., 1 takelis). Palyginti su nepaveikta kontrole, EAV RTC tyrimo metu buvo pagaminta maždaug 30 proc. mažiau RNR. Tai atitiko 30 proc. trumpesnį reakcijos laiką, pridėjus MgEDTA (100 min., palyginti su 70 min., atitinkamai 1-ajame ir 4-ajame takeliuose). Įdomu tai, kad SARS-CoV RTC testai, kurie buvo paeiliui papildyti Zn2+ ir MgEDTA, įterpė šiek tiek daugiau [α-32P]CMP, palyginti su nepaveiktomis kontrolinėmis reakcijomis (3C pav., palyginti 1-ąjį ir 4-ąjį takelius). Šį poveikį sukėlė ne jau nusodinus ląstelių branduolius gautame supernatante (PNS, angl. post-nuclear supernatant) stebimas Zn2+ chelavimas SARS-CoV užkrėstose ląstelėse, nes tokio padidėjimo nebuvo pastebėta į kontrolines reakcijas be pridėto Zn2+ įdėjus MgEDTA (3C pav., 2-as takelils).
Cinko jonai paveikia rekombinantinių nidovirusų RdRp aktyvumą in vitro
Norint nustatyti, ar RTC aktyvumo slopinimą galėtų sukelti tiesioginis Zn2+ poveiks RdRp aktyvumui, ištyrėme Zn2+ poveikį išgrynintoms rekombinantinėms SARS-CoV (nsp12) ir EAV (nsp9) RdRp, naudodami prieš tai sukurtus RdRp testus [27,28]. EAV RdRp įterpė [α-32P]AMP į iki 18 nukleotidų (nt) ilgio produktus, naudojant poliU 18-mero matricą (4A pav.). Iniciacija vyko de novo, o tai atitinka ankstesnius stebėjimus ir konservatyvios nsp9 sekoje esančios žymėjimo kilpos buvimą [28]. Kitaip nei EAV RdRp nsp9 atveju, buvo parodyta, kad SARS-CoV RdRp nsp12, kuri neturi žymėjimo kilpos, in vitro aktyvumas yra griežtai priklausomas nuo pradmenų [27]. Todėl SARS-CoV RdRp nsp12 aktyvumo tyrimui buvo naudota žymėta poliU matrica (4B pav.). Tokiu būdu galėjome tirti [α-32P]AMP įterpimą, kaip aprašyta anksčiau [27]. Kaip specifiškumo kontroles naudojome anksčiau aprašytus SARS-CoV nsp12 mutantą D618A [27], kurio aspartatas pakeistas alaninu RdRp aktyvaus centro A motyve, ir EAV nsp9-D445A, kuriame įvedėme aspartato pakaitą į alaniną atitinkamoje EAV nsp9 vietoje [28,31]. Mūsų atliktų tyrimų metu abi mutantinės RdRp įterpdavo mažiau [α-32P]AMP (4 pav.). Taip dar kartą buvo patvirtinta, kad radioaktyvia žyme žymėtų RNR produktai atsirado dėl nidovirusų RdRp aktyvumo.
Pridėjus ZnOAc2, RdRp testai pasižymėjo stipriu nuo dozės priklausomu tiek EAV, tiek SARS-CoV fermentų fermentinio aktyvumo slopinimu (atitinkamai 5A ir 5B pav.). Panašūs rezultatai stebėti ir atliekant RTC testus. Palyginus su kitais dvivalenčiais metalų jonais, tokiais kaip Co2+ ir Ca2+, kurie įprastai prisijungia prie aminorūgščių šoninių grandinių, turinčių deguonies atomus, o ne sieros grupes, Zn2+ buvo veiksmingiausias SARS-CoV nsp12 RdRp aktyvumo slopiklis (priedų S1 pav.). Norint patikrinti, ar RdRp slopinimas cinko jonais buvo grįžtamas, kaip ir RTC tyrimų atveju, RdRp testų metu buvo naudota 6 mM Zn2+ koncentracija, kuri nuolat užtikrino didesnį nei 95 proc. slopinimą. Praėjus 30 min. tiek į kontrolines reakcijas, tiek į reakcijas, slopintas ZnOAc2, buvo pridedama 8 mM MgEDTA, o mėginiai buvo inkubuojami dar 30 min. (5C pav.). Kaip parodyta 5D paveiksle, EAV RdRp aktyvumo slopinimas Zn2+ galėjo būti panaikintas chelavus Zn2+ (5D pav., palyginti 3-ąjį ir 4-ąjį takelius). Produkto buvo nuolat susintetinama 60 ± 5 proc., palyginti su 60 min. trukusia kontroline reakcija (5D pav., palyginti 1-ąjį ir 4-ąjį takelius). Šis kiekis atitiko tikėtinas ribas, atsižvelgiant į trumpesnį reakcijos laiką. SARS-CoV RdRp slopinimas taip pat buvo grįžtamas. Per 30 min. trukmės inkubacinį laikotarpį pridėjus MgEDTA, SARS-CoV nsp12 įterpė 40 ± 5 proc. žymens, kuris įterpiamas per standartinę 60 min. trukusią reakciją (5E pav.). Šis kiekis buvo šiek tiek mažesnis nei tikėtina išeiga, jo sumažėjimą galėjo nulemti padidėjusi Mg2+ koncentracija, kuri nėra optimali nsp12 aktyvumui ir kuri galėjo atsirasti dėl Mg2+ atpalaidavimo iš MgEDTA dėl Zn2+ chelavimo.
Skirtingas Zn2+ poveikis nidovirusų RNR sintezės iniciacijos ir elongacijos stadijoms
Detali EAV RdRp testų analizė atskleidė, kad Zn2+ poveikis, sintetinant pilno ilgio 18 nt produktus, yra išreikštas mažiau, nei sintetinant mažesnius tarpinius reakcijos produktus (5A pav.). Tai leidžia manyti, kad Zn2+ specifiškai slopino EAV RNR sintezės iniciacijos etapą. Norint patikrinti šią hipotezę, RTC tyrimas buvo atliekamas 30 min. inkubuojant reakcijos mišinį su nežymėtu CTP (iniciacija), po to reakcijos mišinį padalijus į dvi dalis ir į abu mėgintuvėlius įdėjus [α-32P]CMP (impulsas), į vieną iš mėgintuvėlių įdėjus 500 µM Zn2+, o reakcijai vykstant skirtingais laiko momentais imant mėginius (6A pav.). Paveiksle 6B pateikti duomenys, kad esant Zn2+, daugiausia [α-32P]CMP buvo įterpiama į besiformuojančias RNR molekules, kurios jau buvo praėjusios iniciacijos stadiją tuo metu, kai į reakciją buvo įdedama Zn2+. Nauja iniciacija nevyko – tai parodė trumpas radioaktyvia žyme žymėtų produktų brūkšnys, palaipsniui kylantis į viršų link pilno ilgio genominės RNR. Tai rodo, kad Zn2+ nepaveikia EAV RNR sintezės elongacijos stadijos ir specifiškai slopina iniciaciją. Tai taip pat paaiškina santykinai silpną mažesnių sg iRNR juostų signalą (pvz., palyginus santykinį RNA2 ir RNA7 signalo pokytį), gaunamą esant Zn2+. Norint, kad signalo intensyvumas būtų panašus į gaunamą po vieno iniciacijos įvykio ant ilgos genominės RNR, reikia kelių iniciacijos atvejų ant šių trumpų molekulių, pvz. RNA7 atveju – 16 kartų daugiau. Palyginti su EAV, Zn2+ poveikis SARS-CoV RTC RNR sintezei neapsiribojo vien tik slopinimu, tačiau, atrodo, paveikė ir elongacijos stadiją, turint omenyje, kad praėjus 40 min. nuo reakcijos pradžios pridėtas Zn2+ visiškai sustabdė tolimesnį [α-32P]CMP įterpimą (6C pav.)
RdRp testų metu dėl naudotų trumpų matricų techniškai buvo neįmanoma atlikti eksperimentų, panašių į atliktus tiriant RTC. Tačiau jau anksčiau pastebėjome, kad esant mažoms [α-32P]ATP koncentracijoms (maždaug 0,17 µM) SARS-CoV nsp12 RdRp aktyvumas sumažėjo iki pavienio nukleotido prijungimo prie pradmens [27]. EAV nsp9 daugiausia gamino labai trumpus (2–3 nt ilgio) priešlaikius RNR produktus ir tik dalį pilno ilgio produktų, kaip būdinga RdRp pradedant de novo inicijaciją [28]. Tai leido atskirai tirti Zn2+ poveikį iniciacijai ir elongacijai, atliekant eksperimentą, kurio metu po impulso (angl. pulse) etapo, esant mažai [α-32P]ATP koncentracijai, sekė vijimosi (angl. chase) etapas, esant 50 µM nežymėto ATP. Tai padidino procesyvumą ir leido tirti elongaciją (7A ir C pav.) anksčiau aprašytais būdais [27]. Šių eksperimentų rezultatai sutapo su tiriant išskirtus RTC gautais rezultatais. EAV atveju trumpesnių nei 18 nt ilgio tarpinių reakcijos produktų laikui einant mažėjo, kai iniciacija ir dinukleotidų sintezė buvo visiškai nuslopinta, esant 6 mM Zn2+ (priedų S2A pav.), o produktai nuo matricų, ant kurių RdRp jau buvo pradėjusi iniciaciją, buvo pratęsti (elonguoti) iki pilno 18 nt ilgio molekulių (7B pav, dešinė skiltis). Tai sutampa su stebėtais duomenimis, kad EAV RdRp gali pratęsti sintetinį ApA dinukleotidą iki trinukleotidų, esant Zn2+ (priedo S2B pav.). Greičiausiai dėl to, jog 7B paveiksle pavaizduotose reakcijose nevyko reiniciacija, žemo EAV RdRp procesyvumo ir substrato konkurencijos tarp likusio [α-32P]ATP ir daugiau nei 200 kartų didesnio nežymėto ATP pertekliaus, skirtumai tarp 5-ų ir 30-ies minučių laiko momentų buvo maži. Nesant Zn2+, RdRp toliau vykdė iniciaciją – tai galima pastebėti iš mažesnio dydžio RNR molekulių suformuotų dryžių po pilno ilgio produktu (7B pav., kairė skiltis) ir pasiskirstymo skirtingais laiko momentais, pavaizduoto priedų S2A paveiksle. Pridėjus į SARS-CoV RdRp reakciją Zn2+, buvo stebimas priešingas rezultatas: elongacija buvo blokuojama, nes nebevyko radioaktyvia žyme žymėtų pradmenų įterpimas (7D pav., dešinė skiltis), paprastai matomas nesant Zn2+ (7D pav., kairė skiltis).
Cinkas veikia SARS-CoV RdRp matricos prisijungimą
Norint įvertinti, ar mūsų testuose Zn2+ veikia rekombinantinės SARS-CoV nsp12 sąveiką su matrica, atlikome elektromobilumo poslinkio testus (EMSA, angl. electromobility shift assay) esant ir nesant Zn2+ (8A pav.). Norėdami išmatuoti RdRp prisijungimo prie matricos afiniškumą, nustatėme prisijungusios matricos dalį, esant įvairioms baltymo koncentracijoms, ir stebėjome 3–4 kartus sumažėjusį RNR susijungimą, esant Zn2+ (8B pav.). Taip pat įvertinome, ar šiam prisijungimo afiniškumo sumažėjimui būtina RdRp ar RNR inkubuoti su Zn2+ prieš atliekant tyrimą, tačiau neaptikome reikšmingų skirtumų nuo eksperimentų, kuriuose tokia pirminė inkubacija nebuvo vykdoma (duomenys nepateikti).
Atlikus panašią analizę, naudojant EAV RdRp, prisijungimo nebuvo stebima. Lygiai taip pat nsp9 neprisijungė RNR išsodinimo eksperimentuose, naudojant „TALON“ daleles, His6 žymėtą nsp9 ir radioaktyvia žyme žymėtą EAV genominę RNR ar įvairias trumpas RNR matricas, įskaitant ir poliU, nors kontrolinio baltymo (SARS-CoV nsp8, kuris pasižymi RNR ir DNR prisijungiančiu aktyvumu [32]) prisijungimą naudodami šį testą galėjome aptikti. Iki šiol lieka neaišku, kodėl nepavyko aptikti EAV nsp9 prisijungimo prie RNR matricos.
Rezultatų aptarimas
Nors buvo tiriama daug medžiagų, registruoti antivirusiniai preparatai kol kas negali veiksmingai išgydyti SŪRS ir kitų nidovirusų sukeltų ligų [33]. Kuriant antivirusinius vaistus, RdRp yra tinkamas taikinys, nes jų aktyvumas yra susijęs tik su virusais ir gali būti blokuojamas nepažeidžiant gyvybinių ląstelės funkcijų. Kai kurie prieš polimerazes, pvz. prieš žmogaus imunodeficito viruso (ŽIV) ir hepatito C viruso, sukurti antivirusiniai preparatai šiuo metu yra naudojami antivirusinei terapijai ar yra klinikinių tyrimų stadijoje [34,35,36]. Todėl toliau gilinant molekulinės biologijos žinias apie nidovirusų RdRp ir didesnius baltyminius kompleksus, kurių dalį sudaro šios polimerazės, bei panaudojant naujai sukurtų in vitro RdRp testų [25,26,27,28] potencialą galima prisidėti prie veiksmingų antivirusinių strategijų kūrimo.
Cinko jonai ir cinko jonoforai, pvz., PT ar PDTC, anksčiau buvo aprašyti kaip stiprūs įvairių RNR virusų slopikliai. Remdamiesi šiomis žiniomis, ištyrėme, ar PT palengvinta cinko jonų pernaša į ląsteles slopina nidovirusų replikaciją ląstelių kultūroje. Naudodami GFP genų raišką vykdančius EAV ir SARS-CoV [29,30] nustatėme, kad 2 µM PT ir 2 µM Zn2+ derinys veiksmingai slopina virusų replikaciją, tačiau nesukėlia pastebimo citotoksiškumo (1 pav.). Panašios koncentracijos (2–10 µM) PT ir ZN2+ sukeliamas replikacijos slopinimas jau anksčiau buvo pastebėtas, tiriant kai kuriuos pikornavirusus, pvz., rinovirusus, snukio ir kanopų ligos virusą, koksakivirusą ir mengovirusą [6,7,8,9,10,11].
Pikornavirusų replikaciją slopinantis Zn2+ poveikis greičiausiai pasireiškė dėl virusinių polibaltymų apdorojimo blokavimo. Koronaviruso pelių hepatito viruso (MHV, angl. mouse hepatitis virus) infekcijos metu Zn2+ taip pat blokavo kai kurių replikazės polibaltymų skėlimą [24], tačiau esant daug didesnėms koncentracijoms (100 µM Zn2+), nei mūsų tyrimų atveju. Kadangi sumažėjęs replikazės procesyvumas turi netiesioginės įtakos virusinės RNR sintezei užkrėstoje ląstelėje, panaudojome du neseniai sukurtus in vitro tyrimo metodus, siekdami ištirti, ar Zn2+ tiesiogiai veikia nidovirusų RNR sintezę. Mūsų atlikti in vitro tyrimai atskleidė, kad cinko jonai pasižymi stipriu iš EAV ir SARS-CoV išskirtų RTC RNR sintezę slopinančiu poveikiu. Rekombinantinių fermentų tyrimai atskleidė, kad šį poveikį greičiausiai sukėlė tiesioginis RdRp funkcijos blokavimas. Slopinantis poveikis buvo pašalinamas cheluojant cinko jonus. Tokiu būdu sukuriamas įdomus eksperimentinis (įjungimo / išjungimo) metodas nidovirusų RNR sintezės tyrimams. Pridėjus Zn2+ po EAV RNR sintezės iniciacijos, poveikis NTP įjungimui į molekules, kurių sintezė jau buvo inicijuota nesant Zn2+, buvo nedidelis arba jo visai nebuvo (6 ir 7 pav.). Tai leidžia manyti, kad Zn2+ nepaveikia elongacijos ir nepadidina terminacijos dažnio, kaip buvo anksčiau nustatyta su Mg2+ atliktų tyrimų metu [25]. Todėl panašu, kad Zn2+ specifiškai slopina EAV RNR sintezės iniciacijos stadiją. Tačiau SARS-CoV RdRp atveju Zn2+ slopino RNR sintezės aktyvumą ir elongacijos stadijos metu, greičiausiai dėl to, kad tiesiogiai paveikė matricos prisijungimą (8 pav.). Panašu, kad koronavirusų atveju cinko jonai slopina tiek teisingą replikazės polibaltymų proteolitinį apdorojimą [23,24], tiek pačios RdRp aktyvumą (šio tyrimo duomenys). Priešingai nei RTC tyrimų atveju, norint beveik visiškai nuslopinti nukleotidų įterpimą RdRp tyrimų metu, prirekė ne mikromoliais, o milimoliais matuojamų ZnOAc2 koncentracijų.
Gerai žinoma, kad DNR ir RNR polimerazės naudoja trijų konservatyvių aspartato liekanų rinkinį A ir C motyvuose, kad prisijungtų dvivalenčius metalo jonus, pvz. Mg2+, kurie vėliau koordinuoja prijungiamus nukleotidus polimerizacijos reakcijos metu [37,38]. Dvivalenčiai Mg2+ jonai taip pat reikalingi iš SARS-CoV ir EAV išskirtų RTC ir rekombinantinių RdRp aktyvumui in vitro užtikrinti [25,26,27,28], tačiau EAV nsp9 iniciacija de novo priklausoma pirmiausiai nuo Mn2+. Zn2+ negalėjo pakeisti Mg2+ ar Mn2+, kaip kofaktorių, nes nesugebėjo palaikyti nidovirusų RTC ir RdRp polimerazės aktyvumo, nesant Mg2+ (duomenys nepateikti). Tokie rezultatai gauti ir tiriant poliomielito viruso RdRp [39]. Zn2+ sukeliamas RdRp aktyvumo slopinimas buvo stebėtas net esant mažoms jo koncentracijoms ir esant daugiau nei 25 kartų Mg2+ pertekliui. Tai leidžia manyti, kad arba aktyvaus centro afiniškumas Zn2+ yra daug didesnis, arba Zn2+ nekonkuruoja su Mg2+ dėl susirišimo ir prisijungia prie kitos – cinkui specifiškos prisijungimo vietos baltyme.
Cinko jonų turintys specifiniai baltymų domenai ar kišenės gali būti susijusios su baltymų tarpusavio sąveikomis, baltymo ir RNR ar DNR sąveikomis arba fermentų struktūrų konformacijos pokyčiais. Cinką surišantys domenai dažniausiai turi mažiausiai tris konservatyvias cisteino ir (ar) histidino liekanas maždaug 10–30 aminorūgščių ilgio ruože, kaip ir cinko pirštų motyvų ir metaloproteazių atveju [2,40,41]. Tačiau, kalbant apie RdRp, yra tik keletas atvejų, kai yra aptinkamos cinką surišančios kišenės, pvz., jos nustatytos Dengė RdRp kristalinėje struktūroje [42]. EAV nsp9 aminorūgščių sekų analizė atskleidė, kad joje trūksta konservatyvių sričių, kuriose gausu cisteinų ir (ar) histidinų. Atliekant SARS-CoV nsp12 aminorūgščių sekų analizę, nustatytos dvi tokios sritys: H295-C301C306-H309-C310 ir C799-H810-C813-H816. Kol kas nsp12 kristalinė struktūra nėra nustatyta, tačiau yra publikuota nuspėjama struktūra, aprašanti du trečdalius fermento nuo C-galo [31]. Įdomu tai, kad šiame modelyje C799, H810, C813 ir H816 yra erdvėje išsidėstę taip, kad primena Zn2+ koordinuojančias liekanas Dengė viruso RdRp E motyvo Zn2 cinką surišančioje kišenėje (žr. priedų S3 pav.). Žinoma, norint pateikti tolimesnes įžvalgas ir Zn2+ sukeliamo RdRp aktyvumą slopinančio poveikio, aprašyto šiame tyrime, struktūrinį pagrindą reikalinga išsami nidovirusų RdRp analizė, pvz., naudojant struktūrinę analizę ir po jos atliekant mutacijų tyrimus, nutaikytus į prieš tai minėtus cisteinus ir histidinus. Deja, tokie tyrimai gali būti labai sudėtingi, kadangi Zn2+ prisijungimas yra labai trumpalaikis ir neaptinkamas šiuo metu turimais metodais.
Apibendrinant, cinko jonų ir cinko jonoforo PT derinys slopina nidovirusų dauginimąsi ląstelių kultūroje. Tai įdomus pagrindas tyrimams ateityje, panaudojant cinko jonoforus, kaip antivirusinius junginius, tačiau svarbu atkreipti dėmesį ir į jų sisteminį poveikį [43,44], o atsižvelgiant į akivaizdų tokios medžiagos sisteminio toksiškumo trūkumą koncentracijomis, kurios buvo veiksmingos prieš auglius pelių ksenograftų modeliuose [45], tinkamesni gali būti vandenyje tirpūs cinko jonoforai. Zn2+ sukeliamas grįžtamas RdRp slopinimas in vitro taip pat yra patogus įrankis nidovirusinės RNR sintezės molekulinėms detalėms tirti ir atskleidžia naujų mechanistinių skirtumų tarp SARS-CoV ir EAV RdRp.
 1 paveikslas. Cinko jonoforas piritionas slopina nidovirusų dauginimąsi ląstelių kultūroje. (A) Citotoksiškumas Vero-E6 ląstelėms, kai reakcijoje nėra ZnOAc2 (mėlyni skrituliai) ir esant 2 µM (juodi kvadratai), 4 µM (raudoni trikampiai) ar 8 µM (pilki rombai) ZnOAc2 koncentracijai, nustatytas MTS tyrimu praėjus 18 val. po poveikio. (B) Nuo dozės priklausomos kreivės, vaizduojančios PT ir Zn2+ poveikį GFP fluorecencijai Vero-E6 ląstelėse, užkrėstose GFP sintetinančiu EAV reporteriniu štamu 17 val. po infekcijos. Duomenys normalizuoti pagal GFP sintezę užkrėstose nepaveiktose kontrolinėse kultūrose (100 %). Į terpę įdėta Zn2+ koncentracijos: 0 µM (mėlyni skrituliai), 1 µM (žali trikampiai) arba 2 µM ZnOAc2 (juodi kvadratai). (C) PT ir Zn2+ poveikis GFP fluorescencijai Vero-E6 ląstelėse, užkrėstose GFP sintetinančiu SARS-CoV reporteriniu štamu 17 val. po infekcijos. Duomenys normalizuoti pagal GFP sintezę užkrėstose nepaveiktose kontrolinėse kultūrose (100 %). Skirtingas Zn2+ koncentracijos žymi tos pačios spalvos, kaip ir 1B pav. Pasikliautinieji intervalai nurodo standartinį nuokrypį (n = 4). doi:10.1371/journal.ppat.1001176.g001
1 paveikslas. Cinko jonoforas piritionas slopina nidovirusų dauginimąsi ląstelių kultūroje. (A) Citotoksiškumas Vero-E6 ląstelėms, kai reakcijoje nėra ZnOAc2 (mėlyni skrituliai) ir esant 2 µM (juodi kvadratai), 4 µM (raudoni trikampiai) ar 8 µM (pilki rombai) ZnOAc2 koncentracijai, nustatytas MTS tyrimu praėjus 18 val. po poveikio. (B) Nuo dozės priklausomos kreivės, vaizduojančios PT ir Zn2+ poveikį GFP fluorecencijai Vero-E6 ląstelėse, užkrėstose GFP sintetinančiu EAV reporteriniu štamu 17 val. po infekcijos. Duomenys normalizuoti pagal GFP sintezę užkrėstose nepaveiktose kontrolinėse kultūrose (100 %). Į terpę įdėta Zn2+ koncentracijos: 0 µM (mėlyni skrituliai), 1 µM (žali trikampiai) arba 2 µM ZnOAc2 (juodi kvadratai). (C) PT ir Zn2+ poveikis GFP fluorescencijai Vero-E6 ląstelėse, užkrėstose GFP sintetinančiu SARS-CoV reporteriniu štamu 17 val. po infekcijos. Duomenys normalizuoti pagal GFP sintezę užkrėstose nepaveiktose kontrolinėse kultūrose (100 %). Skirtingas Zn2+ koncentracijos žymi tos pačios spalvos, kaip ir 1B pav. Pasikliautinieji intervalai nurodo standartinį nuokrypį (n = 4). doi:10.1371/journal.ppat.1001176.g001
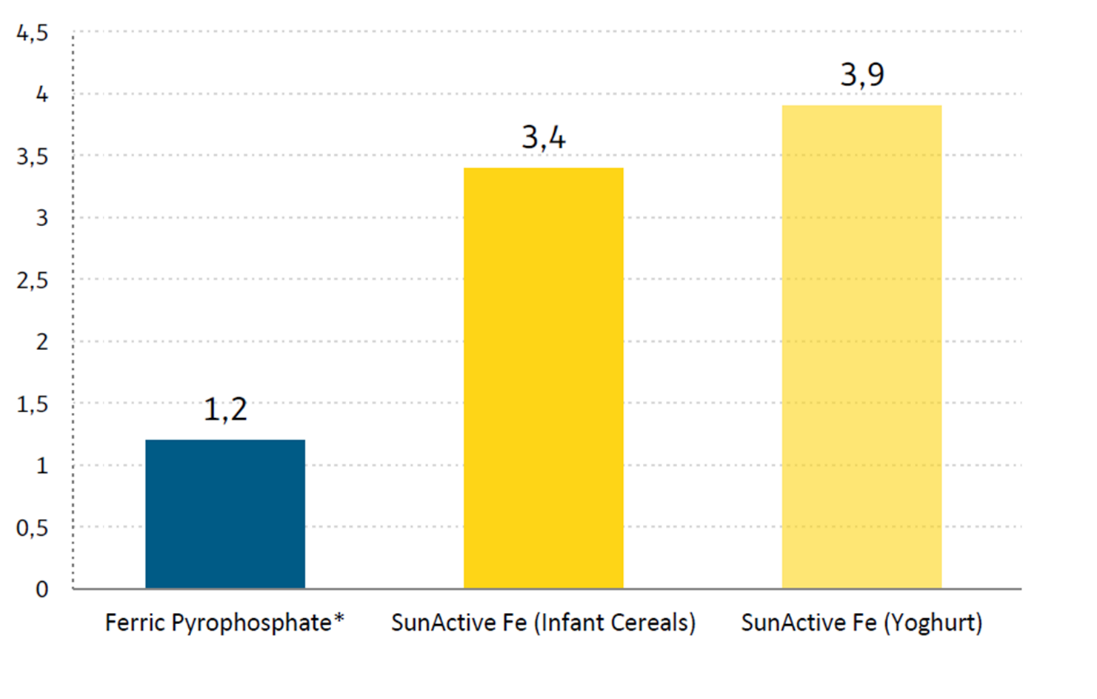 2 paveikslas. Išskirtų RTC RNR sintezės aktyvumo slopinimas Zn2+ in vitro. [α-32P]CMP įterpimo į EAV (A) ir SARS-CoC (B) virusinę RNR tyrimas, esant įvairioms Zn2+ koncentracijoms, nurodytoms virš kiekvieno takelio. doi:10.1371/journal.ppat.1001176.g002
2 paveikslas. Išskirtų RTC RNR sintezės aktyvumo slopinimas Zn2+ in vitro. [α-32P]CMP įterpimo į EAV (A) ir SARS-CoC (B) virusinę RNR tyrimas, esant įvairioms Zn2+ koncentracijoms, nurodytoms virš kiekvieno takelio. doi:10.1371/journal.ppat.1001176.g002
 3 paveikslas. Nidovirusų RTC aktyvumo slopinimas Zn2+ gali būti sustabdytas chelavimu. (A) Išskirtų RTC, kurie buvo inicijuoti su [α-32P]CMP nesant (1 ir 2 mėginiai) arba esant 500 µM Zn2+, tyrimo schema. Po 30 min. trukusios inkubacijos 30 °C temperatūroje ir nepaveikti, ir Zn2+ paveikti mėginiai buvo padalyti į dvi dalis ir į 2-ąjį bei 4-ąjį mėginius įdėta 1 mM Zn2+ chelatoriaus MgEDTA. Visos reakcijos inkubuotos dar 70 min. prieš nutraukiant reakciją. (B) EAV RTC testų metu susintetintų RNR produktų analizė. Skaičiai virš takelių nurodo mėginių numerius, pateiktus (A) dalyje. (C) SARC-CoV RTC aktyvumo tyrimas in vitro. doi:10.1371/journal.ppat.1001176.g003
3 paveikslas. Nidovirusų RTC aktyvumo slopinimas Zn2+ gali būti sustabdytas chelavimu. (A) Išskirtų RTC, kurie buvo inicijuoti su [α-32P]CMP nesant (1 ir 2 mėginiai) arba esant 500 µM Zn2+, tyrimo schema. Po 30 min. trukusios inkubacijos 30 °C temperatūroje ir nepaveikti, ir Zn2+ paveikti mėginiai buvo padalyti į dvi dalis ir į 2-ąjį bei 4-ąjį mėginius įdėta 1 mM Zn2+ chelatoriaus MgEDTA. Visos reakcijos inkubuotos dar 70 min. prieš nutraukiant reakciją. (B) EAV RTC testų metu susintetintų RNR produktų analizė. Skaičiai virš takelių nurodo mėginių numerius, pateiktus (A) dalyje. (C) SARC-CoV RTC aktyvumo tyrimas in vitro. doi:10.1371/journal.ppat.1001176.g003

4 paveikslas. EAV ir SARS-CoV RdRp tyrimai, naudojant laukinio tipo (angl. wild-type) fermentus ir aktyvaus centro mutantus. (A) EAV polimerazė nesugebėjo pratęsti pradmenų; jai reikėjo laisvo 3’ galo ir poli(U) liekanų iniciacijai pradėti. Laukinio tipo fermento ir D455A nsp9 mutanto nukleotidų įterpimo aktyvumas ant 18-mero poli(U) matricos patvirtino mūsų tyrimo specifiškumą. (B) SARS-CoV nsp12 tyrimai buvo atlikti su turinčio 5’ U10 iškyšą RNR duplekso matrica. Stulpelinė diagrama rodo laukinio tipo ir D618A nsp12 nukleotidų įterpimo aktyvumą. Pasikliautinieji intervalai nurodo vidurkio paklaidą (n = 3). doi:10.1371/journal.ppat.1001176.g004
5 paveikslas. EAV ir SARS-CoV RdRp aktyvumas gali būti grįžtamai slopinamas Zn2+. Išgrynintų EAS nsp9 (A) ir SARS-CoV nsp12 (B) RdRp aktyvumas, esant įvairioms Zn2+ koncentracijoms, nurodytoms virš takelių. (C) Eksperimento, skirto nustatyti, ar Zn2+ sukeliamas RdRp aktyvumo slopinimas gali būti panaikintas naudojant MgEDTA, schema. RdRp reakcijos – nepaveiktos kontrolės (1-asis ir 2-asis mėginiai) arba reakcijos su 6 mM Zn2+ (3-iasis ir 4-asis mėginiai) – buvo inkubuotos 30 min. Ir Zn2+ turintys, ir kontroliniai mėginiai buvo padalyti į dvi dalis ir į 2-ąjį bei 4-ąjį mėginius įdėta 6 mM MgEDTA. Visos reakcijos inkubuotos dar 30 min., tada sustabdytos. RdRp tyrimų reakcijos produktai, naudojant EAV nsp9 ir sARS-CoV nsp12, pateikti atitinkamai (D) ir (E). Skaičiai virš takelių nurodo mėginių numerius, pateiktus (C) dalyje. doi:10.1371/journal.ppat.1001176.g005
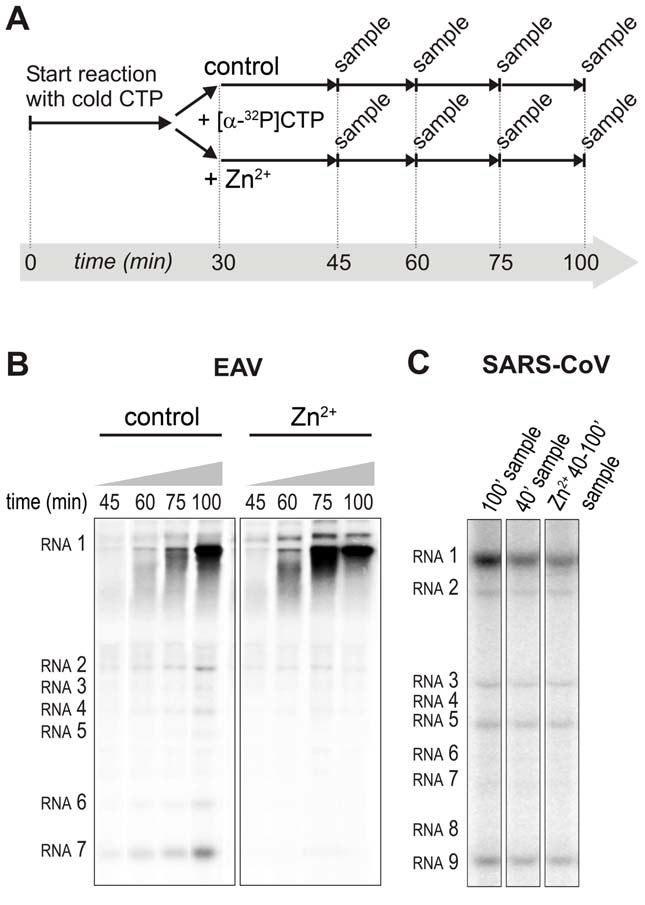 6 paveikslas. Zn2+ poveikis išskirtų EAV ir SARS-CoV RTC iniciacijai ir elongacijai in vitro tyrimuose. (A) Išskirtų EAV RTC tyrimo in vitro metu RTC buvo leista pradėti iniciaciją, naudojant nežymėtus NTP (iniciacija). Po 30 min. pridėta [α-32P]CTP (impulsas). Reakcija padalyta į du lygius tūrius, į vieną iš mėgintuvėlių įdėta Zn2+ iki galutinės 0,5 mM koncentracijos. Nurodytais laiko momentais paimti mėginiai ir tirtas [α-32P]CTP įterpimas į virusinę RNR. (B) Radioaktyvia žyme žymėta EAV RNR, susintetinta nurodytais laiko momentais, esant arba nesant Zn2+. (C) Išskirtų SARS-CoV RTC susintetintos radioaktyvia žyme žymėtos RNR; reakcijos sustabdytos po 100 (1-asis takelis) ir 40 (2-asis takelis) minučių. Reakcijos, į kurią po 40 min. buvo įdėta 500 µM Zn2+ ir kuri buvo sustabdyta t = 100 momentu, produktai parodyti 3-iajame takelyje. doi:10.1371/journal.ppat.1001176.g006
6 paveikslas. Zn2+ poveikis išskirtų EAV ir SARS-CoV RTC iniciacijai ir elongacijai in vitro tyrimuose. (A) Išskirtų EAV RTC tyrimo in vitro metu RTC buvo leista pradėti iniciaciją, naudojant nežymėtus NTP (iniciacija). Po 30 min. pridėta [α-32P]CTP (impulsas). Reakcija padalyta į du lygius tūrius, į vieną iš mėgintuvėlių įdėta Zn2+ iki galutinės 0,5 mM koncentracijos. Nurodytais laiko momentais paimti mėginiai ir tirtas [α-32P]CTP įterpimas į virusinę RNR. (B) Radioaktyvia žyme žymėta EAV RNR, susintetinta nurodytais laiko momentais, esant arba nesant Zn2+. (C) Išskirtų SARS-CoV RTC susintetintos radioaktyvia žyme žymėtos RNR; reakcijos sustabdytos po 100 (1-asis takelis) ir 40 (2-asis takelis) minučių. Reakcijos, į kurią po 40 min. buvo įdėta 500 µM Zn2+ ir kuri buvo sustabdyta t = 100 momentu, produktai parodyti 3-iajame takelyje. doi:10.1371/journal.ppat.1001176.g006
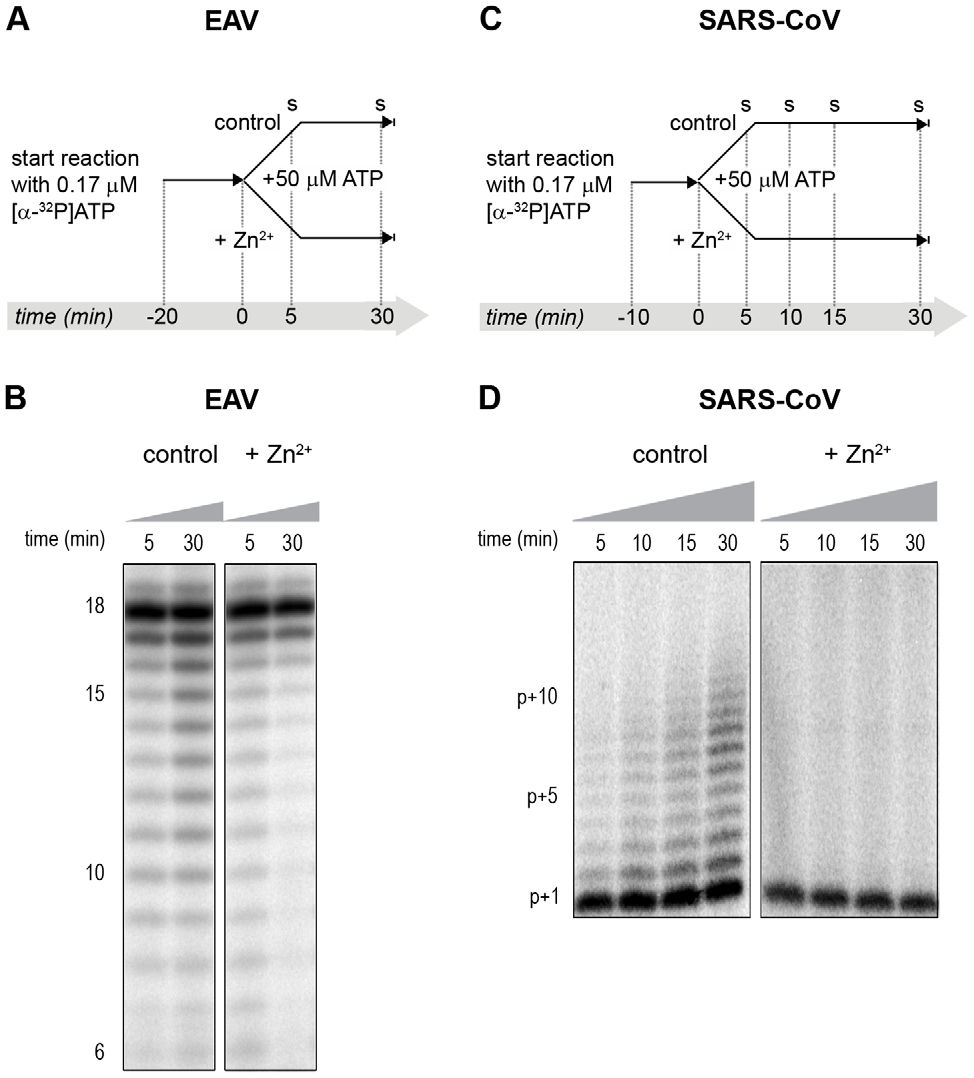
7 paveikslas. Zn2+ poveikis išgrynintų EAV ir SARS-CoV RdRp iniciacijai ir elongacijai. (A) EAV RdRp reakcija buvo inicijuota esant [α-32P]ATP, sudarius sąlygas, kurių metu negalima elongacija, pvz., esant mažai ATP koncentracijai. Po 20 min. reakcija padalyta į du lygius tūrius ir į vieną iš mėgintuvėlių įdėta Zn2+. Vijimosi etapas, panaudojus 50 µM nežymėto ATP, leido vykti elongacijai ir buvo atliktas abiejose reakcijose, o mėginiai paimti po 5-ių ir 30-ies minučių. (B) EAV RdRp reakcijos produktai, susikaupę esant ir nesant Zn2+ (nurodyta virš takelių) po 5-ių ir 30-ies minučių vijimosi etapo, naudojant nežymėtą ATP. Reakcijos produktų ilgis nt nurodytas šalia gelio nuotraukos. (C) SARS-CoV RdRp reakcija buvo inicijuota esant 0,17 µM [α-32P]ATP, tai slopina elongaciją. Reakcija po 10 min. padalyta į du lygius tūrius ir į vieną iš mėgintuvėlių įdėta Zn2+. Vijimosi etapas, panaudojus 50 µM nežymėto ATP, atliktas abiejose reakcijose, o mėginiai paimti po 5-ių, 10-ies, 15-os ir 30-ies minučių. (D) Virš takelių nurodytais vijimosi etapo momentais susidarę SARS-CoV RdRp reakcijos produktai, esant ir nesant Zn2+. Reakcijos produktų ilgis (nt) nurodytas šalia gelio nuotraukos (p – pradmens ilgis). doi:10.1371/journal.ppat.1001176.g007
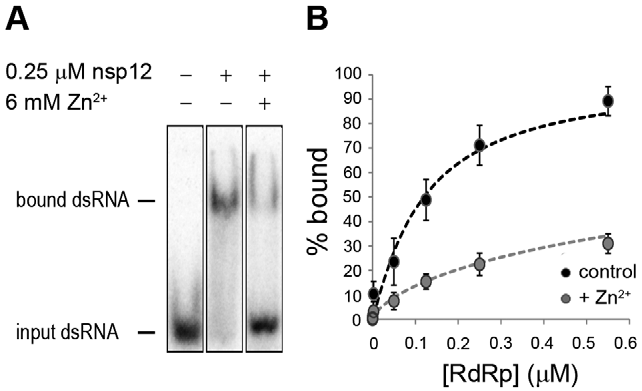
8 paveikslas. Zn2+ poveikis SARS-CoV nsp12 matricos prisijungimui. (A) Elektroforetinio mobilumo poslinkio tyrimas, naudojant radioaktyvia žyme žymėtą dgRNR ir nsp12, esant ir nesant Zn2+ (nurodyta virš takelių). Su nsp12 susijungusios ir nesusijungusios RNR padėtis gelyje yra pažymėta kairėje skilties pusėje. (B) nsp12 afiniškumo RNR nustatymas, esant ir nesant Zn2+. Fiksuotas RNR kiekis inkubuotas su didėjančiu nsp12 kiekiu. Tai parodė, jog esant cinko (pilka spalva) susijungusios RNR dalis sumažėjo 3–4 kartus, palyginti su susijungusios RNR dalimi, kai cinko jonų nėra (juoda spalva). Pasikliautinieji intervalai žymi standartinę vidurkio paklaidą (n = 3). doi:10.1371/journal.ppat.1001176.g008
Medžiagos ir metodai
Ląstelės ir virusai
Vero-E6 ląstelės buvo kultivuojamos ir užkrėstos SARS-CoV (štamas Frankfurt-1; prieigos Nr. AY291315) arba SARS-CoV-GFP, kaip aprašyta anksčiau [46]. Visos procedūros, susijusios su gyvu SARS-CoV, buvo atliktos Leideno universiteto medicinos centro 3 biologinio saugumo lygio įstaigoje. BHK-21 arba Vero-E6 ląstelės buvo kultivuojamos ir užkrėstos EAV (štamas Bucyrus; prieigos Nr. NC_002532) arba EAV-GFP [29], kaip aprašyta anksčiau [25].
Cinko jonų poveikis nidovirusų replikacijai ląstelių kultūroje
Vieną dieną prieš infekciją Vero-E6 ląstelės buvo užsėjamos į permatomas arba juodas (žemo fluorescencijos lygio) 96 šulinėlių grupes po 10 000 ląstelių šulinėlyje. Kitą dieną ląstelės buvo užkrečiamos SARS-CoC-GFP arba EAV-GFP, m.o.i. reikšmei esant 4, o 1 h p.i. inokuliatas pašalintas ir į kiekvieną šulinėlį pridėta 100 µl terpės, kurioje yra 2 % embrioninio jaučio serumo (FCS, angl. fetal calf serum). Kai kurių eksperimentų metu buvo pridedama 0–32 µM piritiono („Sigma“) kartu su 0–2 µM ZnOAc2. Užkrėstos ląstelės užfiksuojamos 17 h p.i. išsiurbiant terpę ir pridedant 3 % paraformaldehido, ištirpinto PBS. Praplovus su PBS, GFP sintezė buvo vertinama kiekybiškai, išmatuojant fluorescenciją „LB940 Mithras“ plokštelių skaitytuvu („Berthold“), esant 485 nm bangos ilgiui. Norint nustatyti ZnOAc2 ir PT toksiškumą, ląstelės paveiktos 0–32 µM PT ir 0–8 µM ZnOAc2. Praėjus 18 val. po inkubacijos ląstelių gyvybingumas nustatytas „Cell Titer 96 AQ MTS“ testu („Promega“). EC50 ir CC50 reikšmės apskaičiuotos „Graphpad Prism 5“ programine įranga, naudojant netiesinės regresijos modelį.
RNR matricos ir oligonukleotidai
RNR oligonukleotidai SAV557R (5'-GCUAUGUGAGAUUAAGUUAU-3'), SAV481R (5'-UUUUUUUUUUAUAACUUAAUCUCACAUAGC-3') ir poly(U)18 (5'-UUUUUUUUUUUUUU-UUUU-3') įsigyti iš „Eurogentec“, išgryninti iš 7 M karbamido / 15 % PAGE gelių, naudojant „NAP-10“ kolonėles („GE Healthcare“) pašalintos druskos. RNR dupleksų SAV557R / SAV481R suliejimui oligonukleotidai buvo sumaišyti ekvimoliariniu santykiu sulydimo buferiniame tirpale (20 mM Tris-HCl pH 8,0, 50 mM NaCl ir 5 mM EDTA), denatūruoti pakaitinus iki 90 °C ir palikti lėtai atvėsti iki kambario temperatūros. Po to jie išgryninti iš 15 % nedenatūruojančių PAGE gelių.
Išskirtų RTC virusinės RNR sintezės tyrimai in vitro
SARS-CoV ir EAV RTC išskirti iš užkrėstų ląstelių, o jų aktyvumas patikrintas, kaip aprašyta anksčiau [26]. Norint įvertinti Zn2+ poveikį, į standartines 28 µl tūrio reakcijas įdėta po 1 µl ZnOAc2 pradinio tirpalo iki galutinės 10–500 µM Zn2+ koncentracijos. Kai reakcijos metu reikėdavo cheluoti Zn2+, buvo pridedama magniu praturtintos EDTA (MgEDTA) iki galutinės 1 mM koncentracijos. 32P žymėti reakcijos produktai po RNR išskyrimo buvo frakcionuojami denatūruojančiuose 1 % (SARS-CoV) arba 1,5 % (EAV) agarozės formaldehido geliuose. [α-32P]CMP įterpimas į virusinę RNR išmatuotas naudojant džiovintų gelių fosforo vaizdinimą „Typhoon“ („GE Healthcare“) skeneriu ir „ImageQuant TL 7“ programinę įrangą („GE Healthcare“).
Nidovirusų RdRp sintezė ir gryninimas
SARS-CoV nsp12 ir EAV nsp9 išgryninti kaip aprašyta anksčiau [27,28], tačiau su pakeitimais, gryninant nsp9. Trumpai, E. coli BL21(DE3) kamienas, turintis pDEST11-nsp9-CH plazmidę, buvo augintas automatinės indukcijos terpėje ZYM-5052 [47] 6 valandas 37 °C temperatūroje, o vėliau 16 valandų 20 °C temperatūroje. Po lizės A buferiniame tirpale (20 mM HEPES pH 7,4, 200 mM NaCl, 20 mM imidazolo ir 0,05 % „Tween-20“) supernatantas perkeltas į „HisTrap“ kolonėlę („GE Healthcare“). Eliucija atlikta naudojant 20–250 mM imidazolo gradientą buferiniame A tirpale. nsp9 turinti frakcija toliau gryninta gelio filtracijos būdu 20 mM HEPES, 300 mM NaCl ir 0,1 % „Tween-20“ tirpale „Superdex 200“ kolonėlėje („GE Healthcare“). Nsp9-CH turinčios frakcijos sujungtos, dializuotos prieš 1000 tūrių B buferinio tirpalo (20 mM HEPES, 100 mM NaCl, 1 mM DTT ir 50 % glicerolio) ir laikytos –20°C. RdRp, turinčios D618A (SARS-CoV) arba D445A (EAV) mutacijas, gautos į vietą nukreiptos mutagenezės metodu laukinio tipo (wt) plazmidėje pDEST14-nsp9-CH [28], naudojant oligonukleotidus 5'-TACTGCCTTGAAACAGCC-CTGGAGAGTTGTGAT-3' ir 5'-ATCACAACTCTCCAGGGCTGTTTCAAGGCAGTA-3', bei plazmidėje pASK3-Ub-nsp12-CHis6, naudojant oligonukleotidus 5'-CCTTATGGGTTGGGCTT-ATCCAAAATGTG-3' ir 5'-CACATTTTGGATAAGCCCAACCCATAAGGA-3', kaip aprašyta anksčiau [27]. Mutantiniai baltymai gryninti lygiagrečiai su laukinio tipo baltymais.
RdRp tyrimai, naudojant išgrynintus fermentus
Standartinės RdRp tyrimo reakcijos sąlygos, naudojant 0,1 µM išgryninto SARS-CoV nsp12, aprašytos kitur [27]. Siekiant ištirti Zn2+ poveikį šio tyrimo metu, į 5 µl reakcijos mišinio įdėta 0,5 µl nuo 0 iki 80 mM skiesto ZnOAc2, taip gaunant galutinę 0–8 mM Zn2+ koncentraciją. EAV RdRd tyrimui naudota 1 µM nsp9, 1 µM RNA matricos poli(U)18, 0,17 µM [α-32P]ATP (0,5 µCi/µl; „Perkin-Elmer“), 50 µMATP, 20 mMTris-HCl (pH 8,0), 10 mM NaCl, 10 mM KCl, 1 mM MnCl2, 4 mM MgOAc2, 5 % glicerolio, 0,1 % „Triton-X100“, 1 mM DTT ir 0,5 vieneto „RNaseOUT“. Į reakciją įdėta ZnOAc2 iki galutinės 0–6 mM koncentracijos. Norint cheluoti Zn2+ reakcijų metu buvo dedama MgEDTA iki galutinės 8mM koncentracijos. Reakcijos buvo stabdomos po 1 valandos ir analizuojamos, kaip aprašyta [27].
SARS-CoV nsp12 elektroforetinio mobilumo poslinkio tyrimas
SARS-CoV RdRp buvo 10 min. inkubuojama su 0,2 nM 5’ 32P žymėtu SAV557R / SAV481R RNR dupleksu, esant arba nesant 6 mM ZnOAc2. Reakcijos tirtos, kaip aprašyta anksčiau [27].
Priedai
S1 paveikslas. Įvairių dvivalenčių katijonų poveikis SARS-CoV RdRp nsp12 aktyvumui. Išgrynintas rekombinantinis SARS-CoV nsp12 baltymas buvo inkubuoti su žymėta matrica, ATP ir [α-32P]ATP, esant arba vien 6 mM Mg2+ (1-asis takelis), arba didėjančioms antro dvivalenčio metalo (M+) koncentracijoms: 2–6 mM Ca2+ (2–4 takeliai), 2–6 mM Co2+ (5–7 takeliai), 2–6 mM Zn2+ (8–10 takeliai) arba 2–6 mM Mn2+ (11–13 takeliai). Stipriausias slopinimas stebėtas reakcijoje esant Zn2+. Daugiau informacijos pateikta pagrindiniame tekste.
Peržiūrėti galima: doi:10.1371/journal.ppat.1001176.s001 (1.55 MB TIF)
S2 paveikslas. Zn2+ poveikis EAV nsp9 dinukleodtidų pratęsimo aktyvumui. Išgrynintas rekombinantinis EAV nsp9 baltymas buvo inkubuojamas su U18 matrica, esant [α-32P]ATP, ATP, 4 mM Mg2+, 1 mM Mn2+ ir 1 µM ApA. (A) Reakcijų mišiniai padalyti į dvi dalis, į vieną iš jų įdėta 6 mM Zn2+, o mėginiai paimti nurodytais (minutėmis) virš takelių laiko momentais. Nesant Zn2+, EAV nsp9 inicijuoja de novo sintezę ir gamina di- ir trinukleotidus, atitinkamai pažymėtus A2 ir A3. Nespecifinė juosta tarp A2 ir A3, kuri nėra susijusi su RdRp aktyvumu, pažymėta žvaigždute. Esant 6 mM Zn2+, dinukleotidų ir trinukleotidų sintezė buvo blokuojama. (B) Atliekant (A) dalyje aprašytus tyrimus, be Zn2+ susidaro pilno ilgio 18 nukleotidų ilgio produktas. Šis produktas nėra stebimas esant 6 mM Zn2+, tačiau nsp9 galėjo vykdyti dinukleotidinio ApA pradmens elongaciją iki tri- (ApA*pA) ir tetranukleotido (ApA*pA*pA) produkto (žvaigždutė žymi radioaktyvia žyme žymėtus fosfatus). Dėl 5’ trifosfato grupės trūkumo reakcijos produktai 20 % akrilamido gelyje migruoja lėčiau, todėl šiam tyrimui naudoti 7 M karbamido geliai. Daugiau EAV nsp9 RdRp eksperimentus aprašančių duomenų pateikta pagrindiniame tekste.
Peržiūrėti galima: doi:10.1371/journal.ppat.1001176.s002 (2.16 MB TIF)
3S paveikslas. Spėjamos cinką surišančios liekanos numanomoje SARS-CoV nsp12 baltymo struktūroje ir palyginimas su Dengė viruso RdRp cinką turinčio domeno struktūra. (A) Koronavirusų RdRp sekų palyginimas rodo koronaviruso nsp12 C-galo domene esančių keturių potencialių cinką surišančių aminorūgščių liekanų (SARS-CoV atveju, C799-H810-C813-H816, pažymėta žvaigždutėmis) konservatyvumą. Juoda spalva rodo visišką konservatyvumą tarp koronavirusų. Koronavirusų RdRp sekos buvo sulygintos naudojant „Muscle 3.6“. Sulygintos sekos ir jų prieigos NCBI numeriai: pelių hepatito viruso štamas A59 (MHV_A59; NP_068668), žmogaus koronavirusas 229E (HCoV_229E; NP_068668), užkrečiamo bronchito viruso štamas Beaudette (IBV_B; P0C6Y1), galvijų koronavirusas (BCoV; NP_742138.1), kačių koronavirusas (FeCoV; YP_239353.1) ir SARS-CoV štamas Frankfurt-1 (SARS_Fr1; AAP33696). (B) Dengė viruso RdRp domeno kristalinė struktūra, nurodanti keturių cisteino ir histidino liekanų, formuojančių Zn2+ surišančią kišenę Zn2, padėtį. Ji yra šalia E motyvo (raudona spalva). Antroji Zn2+ surišanti kišenė (Zn1) ir du cinko jonai kristalinėje struktūroje pažymėti mėlyna ir pilka spalvomis. (C) Spėjamos SARS-CoV nsp12 baltymo kristalinės struktūros trimatis modelis (Xu ir kt.,Nucl. Acids Res. 31: 7117–7130), paremtas PDB kodu 1O5S, modeliuotas su „Swiss-PdbViewe 4.01“ ir „POV-Ray 3.6“. Pažymėtos konservatyvių cisteinų ir histidinų liekanų padėtys A skiltyje (C799-H810-C813-H816) šalia E motyvo (pavaizduotas raudona spalva) ir RdRp aktyvaus centro liekanos (D618, D760 ir D761). Erdvinis šių cisteinų ir histidinų išsidėstymas šiame modelyje yra labai panašus į Dengė viruso RdRp domene esančios Zn surišančios kišenės Zn2 metalo jonus koordinuojančių liekanų išsidėstymą (žr. B skiltį).
doi:10.1371/journal.ppat.1001176.s003 (0.86 MB TIF)
Autorių įnašas
Eksperimentus sugalvojo ir suplanavo: AJWtV, SHEvdW, EJS, MJvH. Eksperimentus atliko: AJWtV, SHEvdW, MJvH. Duomenis analizavo: AJWtV, SHEvdW, ACS, RS,B EJS, MJvH. Prisidėjo reagentais, medžiagomis, analizės įrankiais: ACS, RSB. Parašė straipsnį: AJWtV, EJS, MjvH.
Literatūros sąrašas
1. Lazarczyk M, Favre M (2008) Role of Zn2+ ions in host-virus interactions. J Virol 82: 11486–11494.
2. Frederickson CJ, Koh JY, Bush AI (2005) Neurobiology of zinc in health and disease. Nat Rev Neurosci 6: 449–462.
3. Alirezaei M, Nairn AC, Glowinski J, Premont J, Marin P (1999) Zinc inhibits protein synthesis in neurons: potential rol of phosphorylation of translation initiation factor-2a. J Biol Chem 274: 32433–32438.
4. Uchide N, Ohyama K, Bessho T, Yuan B, Yamakawa T (2002) Effect of antioxidants on apoptosis induced by influenza virus infection: inhibition of viral gene replication and transcription with pyrrolidine dithiocarbamate. Antiviral Res 56: 207–217.
5. Suara RO, Crowe JEJ (2004) Effect of zinc salts on respiratory syncytial virus replication. Antimicrob Agents Chemother 48: 783–790.
6. Gaudernak E, Seipelt J, Triendl A, Grassauer A, Kuechler E (2002) Antiviral Effects of Pyrrolidine Dithiocarbamate on Human Rhinoviruses. J Virol 76: 6004–6015.
7. Si X, McManus BM, Zhang J, Yuan J, Cheung C, et al. (2005) Pyrrolidine Dithiocarbamate Reduces Coxsackievirus B3 Replication through Inhibition of the Ubiquitin-Proteasome Pathway. J Virol 79: 8014–8023.
8. Korant BD, Kauer JC, Butterworth BE (1974) Zinc ions inhibit replication of rhinoviruses. Nature 248: 588–590.
9. Polatnick J, Bachrach HL (1978) Effect of zinc and other chemical agents on foot- and-mouth-disease virus replication. Antimicrob Agents Chemother 13: 731–734.
10. Lanke K, Krenn BM, Melchers WJG, Seipelt J, van Kuppeveld FJM (2007) PDTC inhibits picornavirus polyprotein processing and RNA replication by transporting zinc ions into cells. J Gen Virol 88: 1206–1217.
11. Krenn BM, Gaudernak E, Holzer B, Lanke K, Van Kuppeveld FJM, et al. (2009) Antiviral Activity of the Zinc Ionophores Pyrithione and Hinokitiol against Picornavirus Infections. J Virol 83: 58–64.
12. Zalewski PD, Forbes IJ, Betts WH (1993) Correlation of apoptosis with change in intracellular labile Zn(II) using Zinquin [(2-methyl-8-p-toluenesulphonamide- 6-quinolyloxy)acetic acid], a new specific fluorescent probe for Zn(II). Biochem J 296: 403–408.
13. Baum EZ, Bebernitz GA, Palant O, Mueller T, Plotch SJ (1991) Purification, properties, and mutagenesis of poliovirus 3C protease. Virology 165: 140–150.
14. Cordingley MG, Register RB, Callahan PL, Garsky VM, Colonno RJ (1989) Cleavage of small peptides in vitro by human rhinovirus 14 3C protease expressed in Escherichia coli. J Virol 63: 5037–5045.
15. Ferrari E, Wright-Minogue J, Fang JW, Baroudy BM, Lau JY, et al. (1999) Characterization of soluble hepatitis C virus RNA-dependent RNA polymerase expressed in Escherichia coli. J Virol 73: 1649–1654.
16. Hung M, Gibbs CS, Tsiang M (2002) Biochemical characterization of rhinovirus RNA-dependent RNA polymerase. Antiviral Res 56: 99–114.
17. Perlman S, Netland J (2009) Coronaviruses post-SARS: update on replication and pathogenesis. Nat Rev Micro 7: 439–450.
18. Gorbalenya AE, Enjuanes L, Ziebuhr J, Snijder EJ (2006) Nidovirales: evolving the largest RNA virus genome. Virus Res 117: 17–37.
19. Snijder EJ, Bredenbeek PJ, Dobbe JC, Thiel V, Ziebuhr J, et al. (2003) Unique and conserved features of genome and proteome of SARS-coronavirus, an early split-off from the coronavirus group 2 lineage. J Mol Biol 331: 991–1004.
20. Pasternak AO, Spaan WJ, Snijder EJ (2006) Nidovirus transcription: how to make sense…? J Gen Virol 80: 1403–1421.
21. Sawicki SG, Sawicki DL, Siddell SG (2007) A Contemporary View of Coronavirus Transcription. J Virol 81: 20–29.
22. Butterworth BE, Korant BD (1974) Characterization of the large picornaviral polypeptides produced in the presence of zinc ion. J Virol 14: 282–291.
23. Denison MR, Perlman S (1986) Translation and processing of mouse hepatitis virus virion RNA in a cell-free system. J Virol 60: 12–18.
24. Denison MR, Zoltick PW, Hughes SA, Giangreco B, Olson AL, et al. (1992) Intracellular processing of the N-terminal ORF 1a proteins of the coronavirus MHV-A59 requires multiple proteolytic events. Virology 189: 274–284.
25. van Hemert MJ, de Wilde AH, Gorbalenya AE, Snijder EJ (2008) The in Vitro RNA Synthesizing Activity of the Isolated Arterivirus Replication/Transcription Complex Is Dependent on a Host Factor. J Biol Chem 283: 16525–16536.
26. van Hemert MJ, van den Worm SHE, Knoops K, Mommaas AM, Gorbalenya AE, et al. (2008) SARS-Coronavirus Replication/Transcription Complexes Are Membrane-Protected and Need a Host Factor for Activity In Vitro. PLoS Pathog 4: e1000054.
27. te Velthuis AJ, Arnold JJ, Cameron CE, van den Worm SH, Snijder EJ (2009) The RNA polymerase activity of SARS-coronavirus nsp12 is primer dependent. Nucleic Acids Res 38: 203–214.
28. Beerens N, Selisko B, Ricagno S, Imbert I, van der Zanden L, et al. (2007) De Novo Initiation of RNA Synthesis by the Arterivirus RNA-Dependent RNA Polymerase. J Virol 81: 8384–8395.
29. van den Born E, Posthuma CC, Knoops K, Snijder EJ (2007) An infectious recombinant equine arteritis virus expressing green fluorescent protein from its replicase gene. J Gen Virol 88: 1196–1205.
30. Sims AC, Burkett SE, Yount B, Pickles RJ (2008) SARS-CoV replication and pathogenesis in an in vitro model of the human conducting airway epithelium. Virus Res 133: 33–44.
31. Xu X, Liu Y, Weiss S, Arnold E, Sarafianos SG, et al. (2003) Molecular model of SARS coronavirus polymerase: implications for biochemical functions and drug design. Nucleic Acids Res 31: 7117–7130.
32. Zhai Y, Sun F, Li X, Pang H, Xu X, et al. (2005) Insights into SARS-CoV transcription and replication from the structure of the nsp7-nsp8 hexadecamer. Nat Struct Mol Biol 12: 980–986.
33. Stockman LJ, Bellamy R, Garner P (2006) SARS: Systematic Review of Treatment Effects. PLoS Med 3: e343.
34. Thompson A, Patel K, Tillman H, McHutchison JG (2009) Directly acting antivirals for the treatment of patients with hepatitis C infection: A clinical development update addressing key future challenges. J Hepatol 50: 184–194.
35. De Clercq E (2004) Antivirals and antiviral strategies. Nat Rev Microbiol 2: 704–720.
36. Thompson AJV, McHutchison JG (2009) Antiviral resistance and specifically targeted therapy for HCV (STAT-C). J Viral Hepat 16: 377–387.
37. Yang W, Lee JY, Nowotny M (2006) Making and Breaking Nucleic Acids: Two- Mg2+-Ion Catalysis and Substrate Specificity. Mol Cell 22: 5–13.
38. Castro C, Smidansky E, Maksimchuk KR, Arnold JJ, Korneeva VS, et al. (2007) Two proton transfers in the transition state for nucleotidyl transfer catalyzed by RNA- and DNA-dependent RNA and DNA polymerases. Proc Natl Acad Sci USA 104: 4267–4272.
39. Arnold JJ, Ghosh SK, Cameron CE (1999) Poliovirus RNA-dependent RNA Polymerase (3Dpol). Divalent cation modulation of primer, template and nucleotide selection. J Biol Chem 274: 37060–37069.
40. Iuchi S (2001) Three classes of C2H2 zinc finger proteins. Cell Mol Life Sci 58: 625–635.
41. Gomis-Ruth XF (2009) Catalytic domain architecture of metzincin metallopro- teases. J Biol Chem 284: 15353–15357.
42. Yap TL, Xu T, Chen Y-L, Malet H, Egloff M-P, et al. (2007) Crystal Structure of the Dengue Virus RNA-Dependent RNA Polymerase Catalytic Domain at 1.85-Angstrom Resolution. J Virol 81: 4753–4765.
43. Winek CL, Buehler EV (1966) Intravenous toxicity of zinc pyridinethione and several zinc salts. Toxicol Appl Pharmacol 9: 296–273.
44. Snyder DR, de Jesus CP, Towfighi J, Jacoby RO, Wedig JH (1979) Neurological, microscopic and enzyme-histochemical assessment of zinc pyrithione toxicity. Food Cosmet Toxicol 17: 651–660.
45. Magda D, Lecane P, Wang Z, Hu W, Thiemann P, et al. (2008) Synthesis and anticancer properties of water-soluble zinc ionophores. Cancer Res 68: 5318–5325.
46. Snijder EJ, van der Meer Y, Zevenhoven-Dobbe J, Onderwater JJM, van der Meulen J, et al. (2006) Ultrastr
